La química actúa sobre la materia, que es todo aquello que nos rodea, ocupa un lugar y un espacio en el universo, y que somos capaces de identificar y conocer.
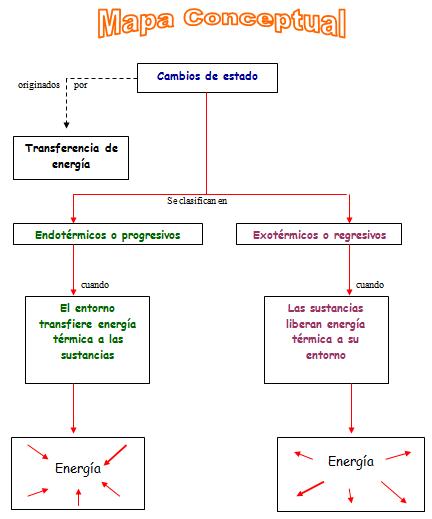
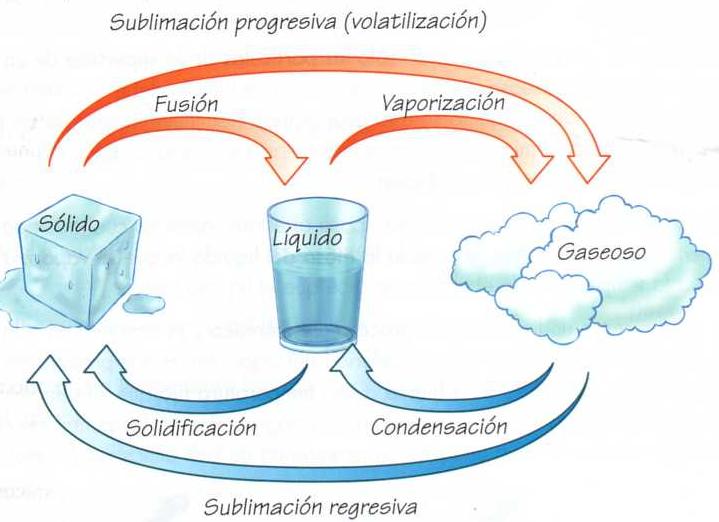
La materia presenta dos tipos de propiedades: propiedades extensivas y propiedades intensivas. Las propiedades extensivas se relacionan con la estructura química externa; es decir, aquellas que podemos medir con mayor facilidad y que dependen de la cantidad y forma de la materia. Por ejemplo: peso, volumen, longitud, energía potencial, calor, etcétera. Las propiedades intensivas, en cambio, tienen que ver más con la estructura química interna de la materia, como la temperatura, punto de fusión, punto de ebullición, calor específico o concentración (ver glosario para estos tres últimos términos), índice de refracción, entre otros aspectos. Las propiedades intensivas pueden servir para identificar y caracterizar una sustancia pura, es decir, aquella que está compuesta por un solo tipo de molécula (ver glosario), como, por ejemplo, el agua, que está formada solo por moléculas de agua (H2O), o el azúcar, que solo la conforman moléculas de sacarosa (C12H22O11). Sólido, líquido y gaseoso La materia normalmente presenta tres estados o formas: sólida, líquida o gaseosa. Sin embargo, existe un cuarto estado, denominado estado plasma, el cual corresponde a un conjunto de partículas gaseosas eléctricamente cargadas (iones), con cantidades aproximadamente iguales de iones positivos y negativos, es decir, globalmente neutro. El estado sólido se caracteriza por su resistencia a cualquier cambio de forma, lo que se debe a la fuerte atracción que hay entre las moléculas que lo constituyen; es decir, las moléculas están muy cerca unas de otras. En el estado líquido, las moléculas pueden moverse libremente unas respecto de otras, ya que están un poco alejadas entre ellas. Los líquidos, sin embargo, todavía presentan una atracción molecular suficientemente firme como para resistirse a las fuerzas que tienden a cambiar su volumen. En cambio, en el estado gaseoso, las moléculas están muy dispersas y se mueven libremente, sin ofrecer ninguna oposición a las modificaciones en su forma y muy poca a los cambios de volumen. Como resultado, un gas que no está encerrado tiende a difundirse indefinidamente, aumentando su volumen y disminuyendo su densidad. La mayoría de las sustancias son sólidas a temperaturas bajas, líquidas a temperaturas medias y gaseosas a temperaturas altas; pero los estados no siempre están claramente diferenciados. Puede ocurrir que se produzca una coexistencia de fases cuando una materia está cambiando de estado; es decir, en un momento determinado se pueden apreciar dos estados al mismo tiempo. Por ejemplo, cuando cierta cantidad de agua llega a los 100ºC (en estado líquido) se evapora, es decir, alcanza el estado gaseoso; pero aquellas moléculas que todavía están bajo los 1001C, se mantienen en estado líquido. Cambios físicos y químicos de la materia Aunque al mirar a nuestro alrededor podemos apreciar distintos estados de la materia (por ejemplo, una silla es materia en estado sólido, la leche un líquido y el humo de las fábricas es gaseoso), en la naturaleza ocurren infinitos cambios a cada instante. Si tomamos, por ejemplo, un vaso con agua (estado líquido), observaremos que el agua ocupa el espacio interno del vaso. Luego, si colocamos en un recipiente el agua contenida en el vaso y la calentamos, veremos que en cierto momento comienzan a observarse burbujas en la superficie, y el agua en estado líquido pasa a ser vapor de agua (estado gaseoso). Este evento, que es común observar en nuestra vida diaria, corresponde a un cambio de estado de la materia. El agua, tanto en estado líquido como en estado gaseoso, presenta la misma composición química (H2O). Los cambios de estado de cualquier material en los que su composición química permanece invariable se denominan cambios físicos. Ahora, si tenemos agua mezclada con azúcar (agua azucarada) y la calentamos hasta evaporar toda el agua posible, en el recipiente queda el azúcar; es decir, se obtienen los materiales iniciales: agua (ahora en forma de vapor) y azúcar. Así, cuando mezclamos dos materiales y podemos separarlos por procedimientos físicos, entonces el cambio ocurrido también es un cambio físico. Otros tipos de cambios físicos pueden ser patear una pelota o romper una hoja de papel. En todos los casos podría cambiar la forma, como cuando cortas el papel, pero la sustancia se mantiene, es decir, el papel sigue estando ahí. Pero existe otro tipo de cambio que sí modifica la estructura química de uno o más materiales. Es el que se conoce como cambio químico. Este sucede cuando el material experimenta una transformación en su estructura química, como consecuencia de su interacción o relación con la estructura química de otro material, transformándose ambas estructuras. Esto da como resultado la formación de un nuevo material con características diferentes a las iniciales; es decir, ocurrió una reacción química. En el experimento de la manzana se puede apreciar un cambio químico, ya que sus constituyentes externos reaccionaron con el oxígeno del aire y se produjo un oscurecimiento por la reacción de oxidación (ver glosario) o envejecimiento. Su estructura interna cambió y ya no es posible recuperarla por medios físicos, por ejemplo, cortar la parte oxidada, ya que solo se obtendría un tejido vegetal nuevo. Las frutas, como las manzanas, pueden conservarse por refrigeración, que hace más lento el proceso de oxidación, o cubriéndolas, para que el oxígeno no actúe sobre la fruta. En el experimento, como habrás podido apreciar, el trozo de manzana cubierto con el plástico no se oscureció. Tampoco la parte de la manzana impregnada con jugo de limón se alteró. Es más, seguirá en buen estado, ya que el jugo de limón contiene vitamina C (ácido ascórbico), la cual actúa como antioxidante; es decir, evita que el oxígeno reaccione con la manzana y retarda el envejecimiento. El tercer trozo, al estar sin jugo de limón y sin plástico (es decir, al estar expuesto al oxígeno del aire) se oscureció, evidenciando una reacción de oxidación, la misma que corresponde a un cambio de estado de tipo químico. En la naturaleza, la mayoría de las alteraciones que se producen son cambios químicos, como la combustión, la pudrición, la fermentación, la digestión de los alimentos, etcétera. Sin embargo, también existen otros tipos de transformaciones químicas, como cuando se quema basura, o uno fundamental, que es la respiración, donde hay una reacción química. Así como la manzana, otras frutas experimentan las mismas modificaciones, como, por ejemplo, el plátano y la palta. Tú mismo puedes repetir el experimento usando otras frutas o verduras, haciendo comparaciones y verificando lo que sucede. Incluso puedes invitar a tus amigos para que cada uno elija una fruta o verdura y después comparen y discutan los resultados de cada uno. Así, aplicarás también el método científico (observación, problema, hipótesis y experimentación). Mezclando sustancias  Ya sabes que todo lo que existe en el universo está compuesto por materia. Esta, a su vez, se clasifica en mezclas y sustancias puras. Las sustancias puras comprenden un solo compuesto, y las mezclas son combinaciones de sustancias puras en proporciones variables o diferentes; por ejemplo, una mezcla de arena y sal. Ya sabes que todo lo que existe en el universo está compuesto por materia. Esta, a su vez, se clasifica en mezclas y sustancias puras. Las sustancias puras comprenden un solo compuesto, y las mezclas son combinaciones de sustancias puras en proporciones variables o diferentes; por ejemplo, una mezcla de arena y sal. Los compuestos están conformados por los elementos (como, por ejemplo, el hidrógeno y el oxígeno, que forman el agua), los cuales existen en los compuestos en una proporción definida, es decir, en cantidades suficientes que permiten que dichos elementos se mantengan siempre estables y que también impiden su separación por métodos físicos. Por ejemplo, si se hace reaccionar sodio (Na) con cloro (Cl2) se obtendrá Na1Cl1 exclusivamente y no sustancias tales como Na0.5Cl2.3 o mezclas raras. Las mezclas se clasifican en homogéneas (soluciones) y en heterogéneas. En una mezcla homogénea no hay distinción de fases, es decir, de una porción de la sustancia pura. Es el caso, por ejemplo, del agua con alcohol, el agua azucarada o el agua con café, donde se observa una sola fase: la líquida. Además, en este tipo de mezcla los componentes se unen hasta el nivel molecular, de manera que no es posible distinguirlos. Por ejemplo: oxígeno en agua o sal en agua. También existen las soluciones sólidas (mezcla de metales), llamadas aleaciones. En las soluciones hay dos sustancias involucradas: una que disuelve, solvente, y otra que se disuelve, el soluto. Cuando mezclamos agua (solvente) con azúcar, tenemos que cada molécula de azúcar (soluto) queda rodeada por varias moléculas de agua. Lo mismo sucede en otras soluciones. Por esta razón, una vez que han sido mezclados no podemos diferenciar a simple vista el soluto del solvente. En cambio, en una mezcla heterogénea pueden distinguirse con facilidad las diferentes fases que forman la mezcla. Por ejemplo, el agua con arena. Aquí se forman dos fases: una fase sólida, conformada por la arena, y otra fase líquida, constituida por el agua. Otros ejemplos son el agua con aceite, sal y arena, entre otros. Las mezclas pueden separarse en sus componentes por procesos físicos, mientras que los compuestos se separan en sus constituyentes por procesos químicos.
En cualquier caso, la mezcla de materiales es un proceso que utilizamos a diario, tanto en la cocina (al mezclar los ingredientes de una torta) como en las industrias altamente tecnificadas (como la farmacéutica). En la naturaleza también encontramos mezclas, como la sangre, la orina y el aire. | Oxígeno para la química |  | | Antonio Lavoisier | Al químico francés Antonio Lavoisier (1743-1794) se atribuye el descubrimiento del oxígeno, al comprobar que el aire está compuesto por este elemento y el nitrógeno. Lavoisier, considerado uno de los fundadores de la química moderna, sostuvo que, para que se realice la respiración, no solo es necesaria la combustión de compuestos carbonados (como los azúcares), sino que se requieren otros elementos, descubriendo así que los seres vivos utilizan el oxígeno del aire para la combustión de los alimentos. También estableció la ley de la conservación de la materia y realizó importantes trabajos sobre la nomenclatura química. Fue guillotinado durante la Revolución Francesa por pertenecer a la nobleza. | | | |
|






 Ya sabes que todo lo que existe en el universo está compuesto por materia. Esta, a su vez, se clasifica en mezclas y sustancias puras. Las sustancias puras comprenden un solo compuesto, y las mezclas son combinaciones de sustancias puras en proporciones variables o diferentes; por ejemplo, una mezcla de arena y sal.
Ya sabes que todo lo que existe en el universo está compuesto por materia. Esta, a su vez, se clasifica en mezclas y sustancias puras. Las sustancias puras comprenden un solo compuesto, y las mezclas son combinaciones de sustancias puras en proporciones variables o diferentes; por ejemplo, una mezcla de arena y sal. 